Wprowadzenie
Ciągły postęp cywilizacyjny i związany z nim rosnący poziom zanieczyszczenia powietrza, jak na przykład wszechobecny smog, przyczyniają się do coraz częstszego występowania chorób płuc. Szczególnie niewielkie cząstki zawieszone w zanieczyszczonym powietrzu są zdolne do depozycji w pęcherzyku płucnym, powodując liczne reakcje patologiczne.
Dużą grupę jednostek chorobowych wywołujących zmiany w obrębie miąższu płucnego są choroby śródmiąższowe płuc (ILD, z ang. interstitial lung diseases), prowadzące do zaburzenia wentylacji układu oddechowego oraz upośledzenia wymiany gazowej. W bardzo wielu przypadkach postępujące zmiany w obrębie miąższu płucnego prowadzą do procesów włóknienia, które mogą też stanowić istotę schorzenia, jak na przykład w idiopatycznym włóknieniu płuc (IPF, z ang. idiopathic pulmonary fibrosis). W tym przypadku reakcja zapalna rozwija się w następstwie niezidentyfikowanego czynnika zewnętrznego, a aktywowany samoczynnie przez organizm proces naprawczy nie przebiega w sposób prawidłowy. W przestrzeni śródmiąższowej gromadzą się fibroblasty i miofibroblasty, a w płucach powstają blizny, prowadząc do włóknienia płuc i trwałej niewydolności oddechowej, a także przyczyniając się do przedwczesnych zgonów – mediana przeżycia chorego z IPF to 3 lata.
Jednym z głównych wyzwań stojących przed specjalistami zajmującymi się ILD jest opracowanie kompleksowej metody diagnostycznej, która pozwoliłyby w sposób jednoznaczny określić, z którą jednostką chorobową mamy do czynienia, umożliwiając szybkie wdrożenie właściwej terapii i poprawienie rokowań. Obecnie rozpoznanie stawiane jest przez konsylium złożone z pulmonologa, radiologa i patomorfologa na podstawie obrazu radiologicznego, histopatologicznego i danych klinicznych z wywiadu. Ponieważ jednak obraz ten w wielu jednostkach chorobowych ILD jest podobny, rozpoznanie jest obarczone dużą niepewnością a podejmowana terapia często nie jest skuteczna. Zwłaszcza rozróżnienie IPF i niespecyficznego śródmiąższowego zapalenia płuc (NSIP, z ang. nonspecific interstitial pneumonia) stanowi wyzwanie, z uwagi na niezwykle podobny obraz kliniczny w przebiegu obu jednostek chorobowych.
Z pomocą w rozwiązaniu tego problemu mogą przyjść badania prowadzone w Zakładzie Biofizyki Molekularnej i Międzyfazowej we współpracy z Kliniką Pulmonologii CM UJ, w ramach finansowanego przez NCN projektu OPUS (UMO-2017/25/B/ST5/00575). Ich celem jest stworzenie podłoży do hodowli fibroblastów płucnych o tak dobranych właściwościach mechanicznych i chemicznych, aby możliwe było sterowanie procesami adhezji i proliferacji komórek, prowadzące do kontrolowanego wzmocnienia lub zahamowania wzrostu określonej linii komórkowej. Określenie zestawu parametrów pozwalających na jednoznaczne rozróżnienie fibroblastów z IPF i NSIP mogłoby stanowić podstawę nowej metody diagnostycznej, która pozwoliłaby na szybkie i jednoznaczne diagnozowanie pacjentów z chorobami śródmiąższowymi płuc, zwiększając ich szansę na wyleczenie i jednocześnie obniżając koszty terapii.
Uzyskane wyniki
Pomiary, przeprowadzone dotychczas dla komercyjnie dostępnych linii fibroblastów prawidłowych (LL24) oraz pochodzących z IPF (LL97A) pokazują jednoznacznie, że zachowanie komórek silnie zależy od elastyczności podłoża na którym są hodowane. Kształt i sposób ułożenia komórek, obserwowane za pomocą mikroskopii fluorescencyjnej, zmieniają się od monowarstw, tworzonych przez rozpłaszczone komórki na podłożu miękkim, do sferycznych obiektów formowanych przez rosnące na sobie fibroblasty na podłożu twardszym (Rysunek 1).
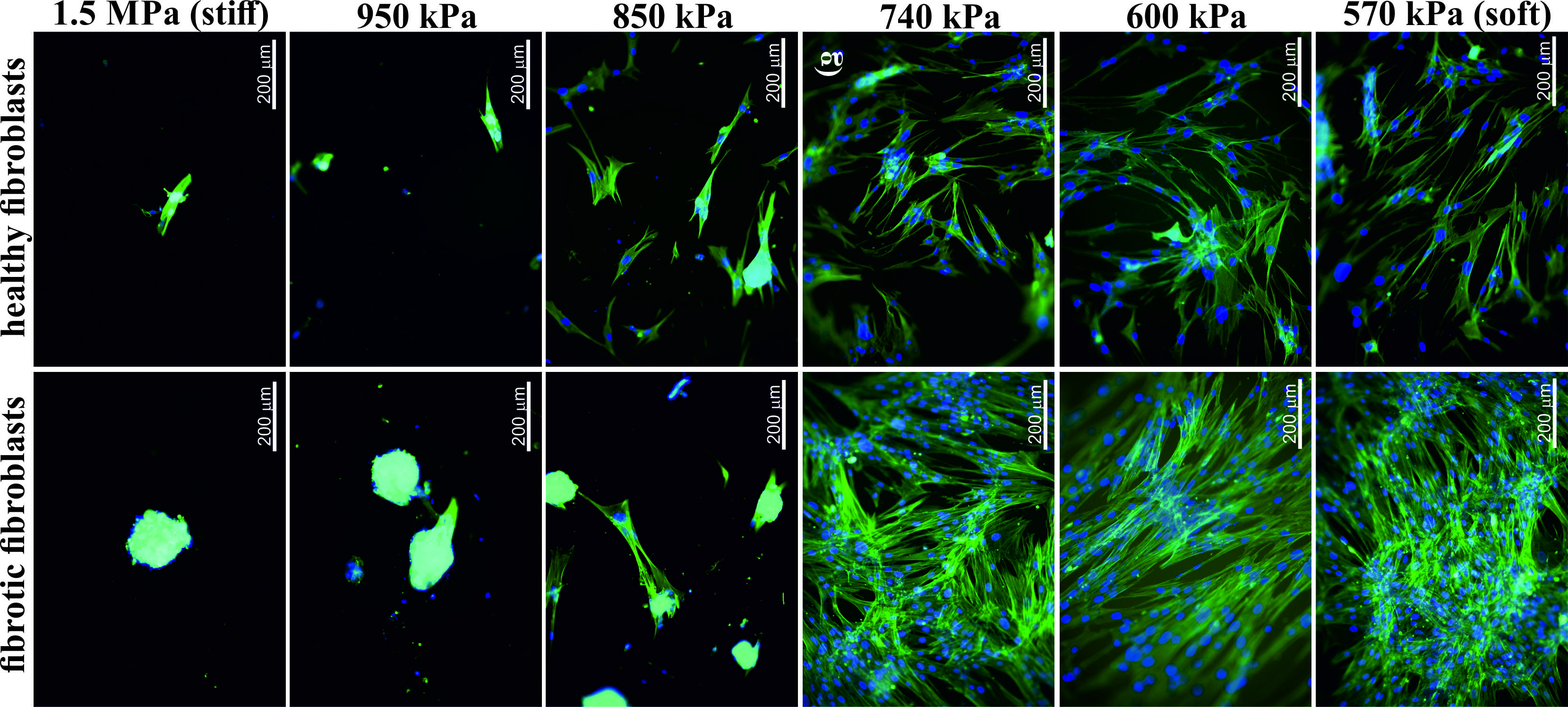
Rysunek 1. Wzrost fibroblastów prawidłowych i pochodzących z IPF na podłożach o różnej elastyczności.
fekt ten pozostaje niezmieniony pomimo zastosowanych modyfikacji chemicznych za pomocą organosilanów (APTES, MPTES, GOPS, Rysunek 2)
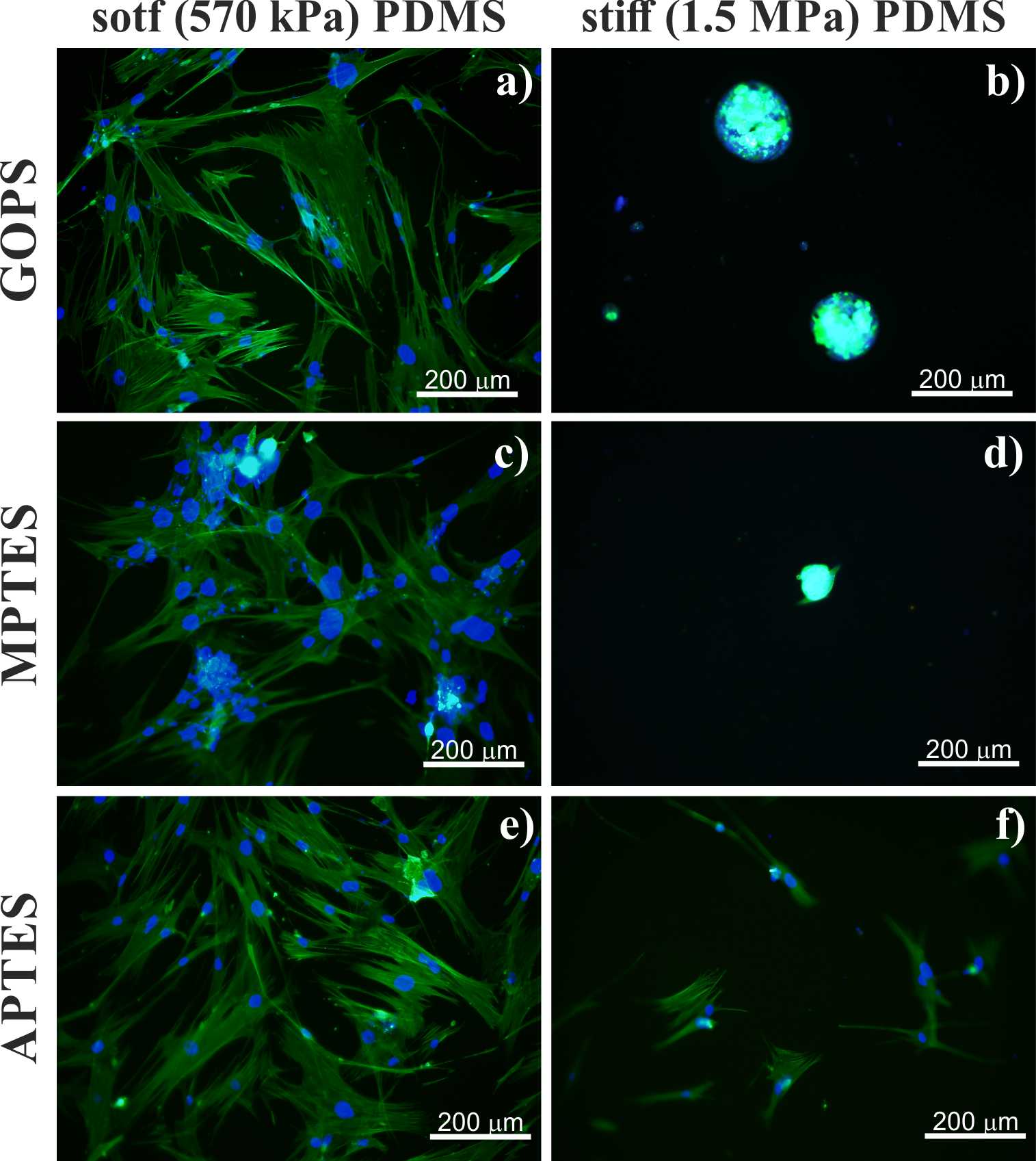
Rysunek 2. Wzrost fibroblastów pochodzących z IPF na podłożach o różnej elastyczności modyfikowanych za pomocą silanów.
Co ciekawe, ilość żywych komórek, monitorowana za pomocą testów kolorymetrycznych nie wykazuje znaczących różnic dla obu podłoży (Rysunek 3) co sugeruje, że elastyczność podłoża wpływa raczej na kształt i sposób ułożenia komórek a nie na ich zdolność do proliferacji.
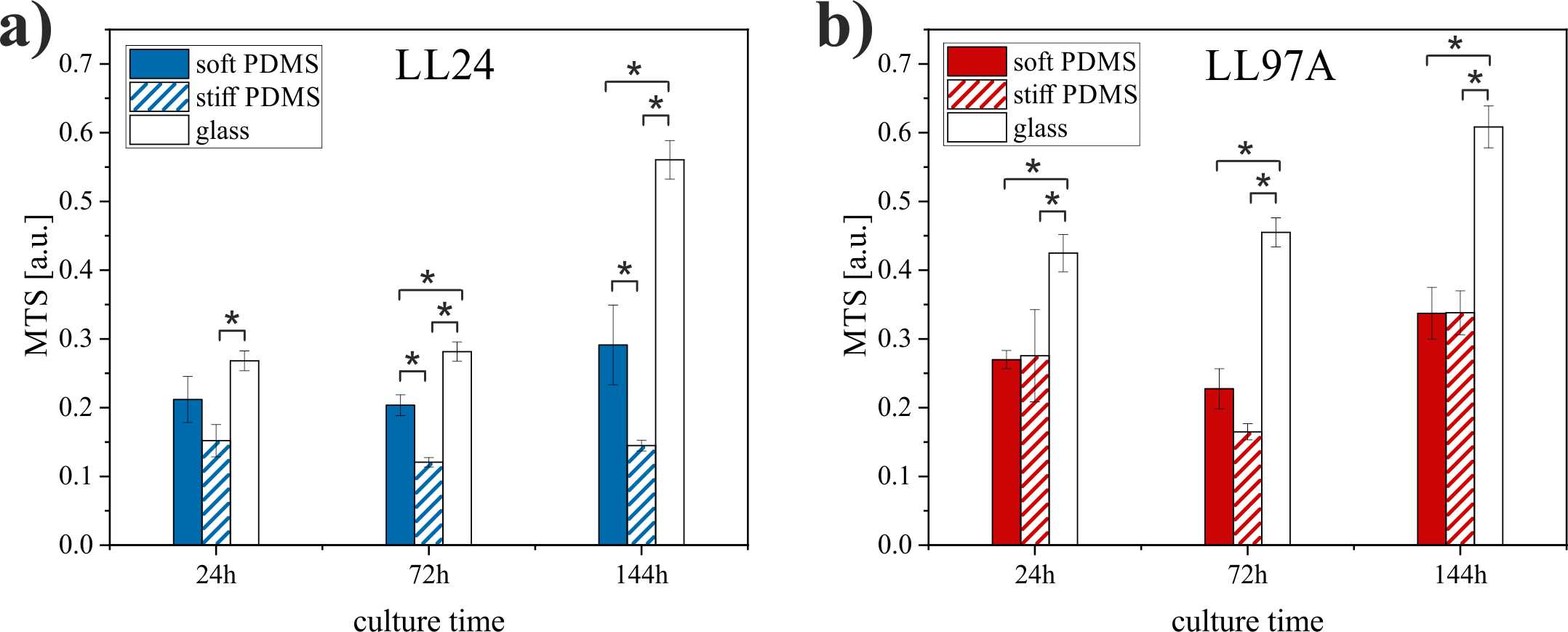
Rysunek 3. Proliferacja fibroblastów prawidłowych (LL24) i pochodzących z IPF (LL97A) na podłożach o różnej elastyczności.
Pomiary właściwości chemicznych, realizowane z wykorzystaniem spektrometru mas jonów wtórnych z analizatorem czasu przelotu (ToF-SIMS) pokazują subtelne, lecz widoczne różnice pomiędzy fibroblastami pochodzącymi z IPF a ich prawidłowymi odpowiednikami (Rysunek 4).
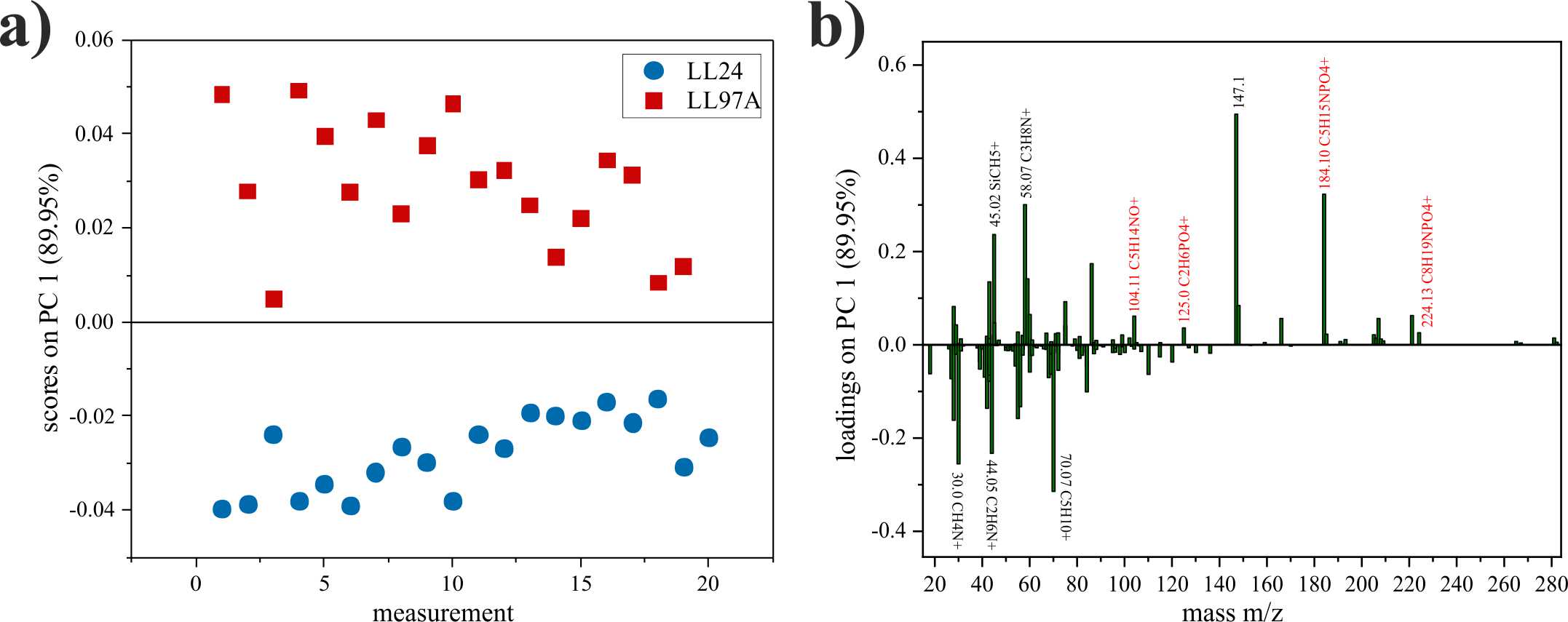
Rysunek 4. Właściwości chemiczne fibroblastów prawidłowych (LL24) i pochodzących z IPF (LL97A).
Najbardziej obiecujące wyniki dają jednak pomiary właściwości mechanicznych komórek, uzyskane za pomocą mikroskopu sił atomowych pracującego w trybie spektroskopii sił (Rysunek 5). Wyraźnie widać tutaj różnice elastyczności komórek hodowanych na różnych podłożach a dla podłoża sztywnego także dużą różnicę w zachowaniu fibroblastów pochodzących z różnych linii. Daje to nadzieję, że właśnie ten parametr będzie mógł stanowić ‘biomarker’ pozwalający na jednoznaczne rozróżnienie pomiędzy prawidłowymi i nieprawidłowymi komórkami.
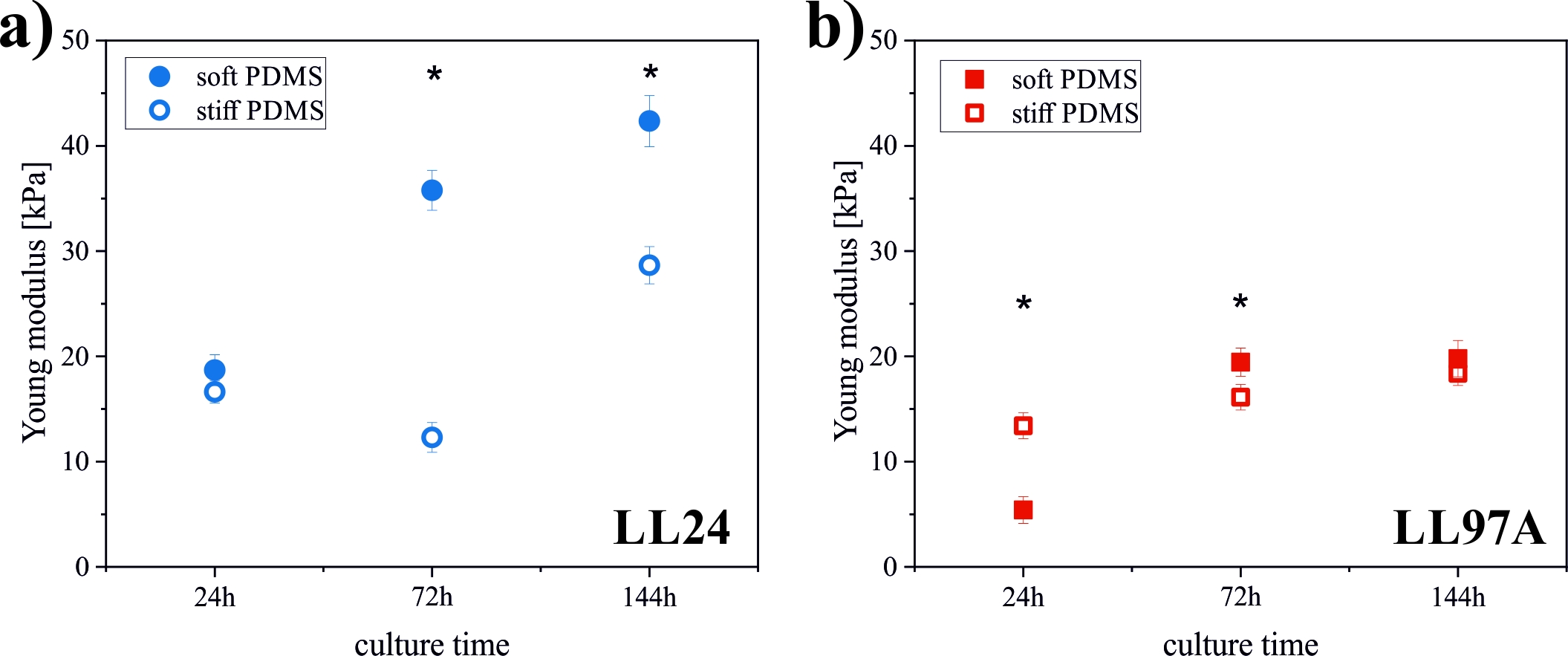
Rysunek 5. Elastyczność fibroblastów prawidłowych (LL24) i pochodzących z IPF (LL97A) na podłożach o różnej elastyczności.
Głównym celem badań prowadzonych w ramach niniejszego projektu jest analiza chemicznych i mechanicznych właściwości fibroblastów z IPF i NSIP na podłożach elastomerowych (polidimetylosiloksan, PDMS) o różnej elastyczności, także imitujących trójwymiarową, porowatą strukturę tkanki płucnej oraz określenie zestawu parametrów fizykochemicznych, pozwalających na jednoznaczne rozróżnienie fibroblastów pochodzących z różnych jednostek chorobowych. Aby dogłębniej zrozumieć skomplikowane mechanizmy prowadzące do włóknienia w przypadku IPF i NSIP, wykorzystane zostaną także podłoża elastomerowe modyfikowane chemicznie za pomocą organosilanów lub białek macierzy zewnątrzkomórkowej. Wyniki prowadzonych eksperymentów będą stanowiły źródło informacji o właściwościach fibroblastów pochodzących z różnych jednostek chorobowych ILP oraz o ich oddziaływaniu z otoczeniem o różnej elastyczności. Pozwoli to na lepsze zrozumienie mechanizmów komórkowych, które prowadzą do procesu włóknienia płuc. Określenie zestawu parametrów pozwalających na jednoznaczne rozróżnienie fibroblastów z IPF i NSIP może stanowić podstawę nowej metody diagnostycznej, która pozwoli na szybkie i jednoznaczne diagnozowanie pacjentów z chorobami śródmiąższowymi płuc, zwiększając ich szansę na wyleczenie i jednocześnie obniżając koszty terapii.
Osoba publikująca: Kamil Awsiuk